Cinétique
Une étude de la cinétique de la réaction A + B → C est effectuée à 25°C, en partant d'une concentration [A0] = [B0] = 0,301 mol.L-1 :
| t (h) | 0 | 4 | 6 | 8 |
| [C] (mol.L-1) | 0 | 1,750×10-1 | 2,190×10-1 | 2,477×10-1 |
Déterminez l'ordre et la constante de vitesse k de la réaction, avant d'en déduire le temps de demi-réaction.
Correction :
Dans ce type d'exercice nous allons devoir calculer k pour chaque valeur de t en prenant la formule associée à chaque ordre jusqu'à ce qu'on trouve une valeur de k qui soit la même pour toutes les valeurs de t, étant donné que c'est censé être une constante. Avant d'aller plus loin il faut toutefois noter que les concentrations qui nous sont données dans le tableau reflètent la vitesse d'apparition des produits, et pas la vitesse de disparition des réactifs comme on voudrait l'avoir. Ce n'est pas un problème énorme, car pour passer de la concentration du produit C à celle du réactif A à un instant donné il suffit de soustraire à la concentration initiale en réactif [A0] la concentration du produit C. En clair, [At] = [A0] - [Ct]. Nous allons calculer chaque valeur de [At] tout de suite pour simplifier les calculs à venir.
- [At = 0] = 3,010×10-1 - 0 = 3,010×10-1 mol.L-1
- [At = 1] = 3,010×10-1 - 1,750×10-1 = 1,260×10-1 mol.L-1
- [At = 2] = 3,010×10-1 - 2,190×10-1 = 8,200×10-2 mol.L-1
- [At = 3] = 3,010×10-1 - 2,477×10-1 = 5,330×10-2 mol.L-1
Ordre 0 :
Pour cet ordre, la formule à utiliser pour trouver k est la suivante :
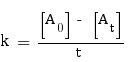
On n'effectue aucun calcul pour t = 0, car il résulterait en la pose d'une division par 0. Nous commençons donc par t = 4 h, valeur pour laquelle nous avons :

On a donc k4 = 4,375×10-2 mol.L-1.h-1. Nous effectuons le calcul pour t = 6 et t = 8, et nous trouvons que k6 = 3,650×10-2 mol.L-1.h-1 et k8 = 3,096×10-2 mol.L-1.h-1.
Les valeurs de k sont ici bien trop différentes les unes des autres pour que l'ordre 0 soit l'ordre réel de la réaction. Il est possible de tolérer une petite variabilité dans la mesure des différentes valeurs de k, mais là les différences sont bien trop grandes pour qu'on puisse les accepter.
Ordre 1 :
Pour cet ordre, la formule à utiliser pour trouver k est la suivante :

Nous commençons par t = 4 h, valeur pour laquelle nous avons :

On a donc k4 = 2,177×10-1 h-1. Nous effectuons le calcul pour t = 6 et t = 8, et nous trouvons que k6 = 2,167×10-1 h-1 et k8 = 2,164×10-1 h-1.
Nous voyons que les valeurs de k pour l'ordre 1 sont à peu près équivalentes pour toutes les températures, nous en déduisons donc que la réaction qu'on a est d'ordre 1 et que k est égal à la moyenne des valeurs de k que nous aurons pu calculer pour l'ordre de la réaction, c'est à dire qu'on assume que k = 2,169×10-1 h-1.
Nous avons donc tout ce qu'il nous faut pour calculer le temps de demi-réaction t1/2, avec la formule adaptée à l'ordre 1 :


Pour conclure, nous avons donc :