Cinétique
Une étude de la cinétique de la réaction A + B → C est effectuée à 25°C, en partant d'une concentration [A0] = [B0] = 0,842 mol.L-1 :
| t (min) | 0 | 10 | 30 | 40 |
| [A] (mol.L-1) | 1,217 | 9,871×10-1 | 5,279×10-1 | 3×10-1 |
Déterminez l'ordre et la constante de vitesse k de la réaction, avant d'en déduire le temps de demi-réaction.
Correction :
Dans ce type d'exercice nous allons devoir calculer k pour chaque valeur de t en prenant la formule associée à chaque ordre jusqu'à ce qu'on trouve une valeur de k qui soit la même pour toutes les valeurs de t, étant donné que c'est censé être une constante.
Ordre 0 :
Pour cet ordre, la formule à utiliser pour trouver k est la suivante :
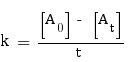
On n'effectue aucun calcul pour t = 0, car il résulterait en la pose d'une division par 0. Nous commençons donc par t = 10 min, valeur pour laquelle nous avons :

On a donc k10 = 2,299×10-2 mol.L-1.min-1. Nous effectuons le calcul pour t = 30 et t = 40, et nous trouvons que k30 = 2,297×10-2 mol.L-1.min-1 et k40 = 2,293×10-2 mol.L-1.min-1.
Nous voyons que les valeurs de k pour l'ordre 0 sont à peu près équivalentes pour toutes les températures, nous en déduisons donc que la réaction qu'on a est d'ordre 0 et que k est égal à la moyenne des valeurs de k que nous aurons pu calculer pour l'ordre de la réaction, c'est à dire qu'on assume que k = 2,296×10-2 mol.L-1.min-1.
Nous avons donc tout ce qu'il nous faut pour calculer le temps de demi-réaction t1/2, avec la formule adaptée à l'ordre 0 :


Pour conclure, nous avons donc :