Cinétique
Une étude de la cinétique de la réaction A + B → C est effectuée à 25°C :
| t (min) | 0 | 20 | 50 | 60 |
| [A] (mol.L-1) | 1,887 | 1,756 | 1,558 | 1,490 |
Déterminez l'ordre et la constante de vitesse k de la réaction, avant d'en déduire le temps de demi-réaction.
Correction :
Dans ce type d'exercice nous allons devoir calculer k pour chaque valeur de t en prenant la formule associée à chaque ordre jusqu'à ce qu'on trouve une valeur de k qui soit la même pour toutes les valeurs de t, étant donné que c'est censé être une constante.
Ordre 0 :
Pour cet ordre, la formule à utiliser pour trouver k est la suivante :
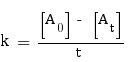
On n'effectue aucun calcul pour t = 0, car il résulterait en la pose d'une division par 0. Nous commençons donc par t = 20 min, valeur pour laquelle nous avons :

On a donc k20 = 6,550×10-3 mol.L-1.min-1. Nous effectuons le calcul pour t = 50 et t = 60, et nous trouvons que k50 = 6,580×10-3 mol.L-1.min-1 et k60 = 6,617×10-3 mol.L-1.min-1.
Nous voyons que les valeurs de k pour l'ordre 0 sont à peu près équivalentes pour toutes les températures, nous en déduisons donc que la réaction qu'on a est d'ordre 0 et que k est égal à la moyenne des valeurs de k que nous aurons pu calculer pour l'ordre de la réaction, c'est à dire qu'on assume que k = 6,582×10-3 mol.L-1.min-1.
Nous avons donc tout ce qu'il nous faut pour calculer le temps de demi-réaction t1/2, avec la formule adaptée à l'ordre 0 :


Pour conclure, nous avons donc :