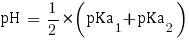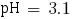Acides-bases
Calculez le pH d'une solution α de 65 mL dans laquelle on dissout 2,57×10-2 moles de HCOOH.
Données : pKa (HCOOH/HCOO-) = 3,75.
Calculez le pH d'une solution β de 100 mL dans laquelle on dissout 9,20×10-3 moles de CH3COCOO-.
Données : pKa (CH3COCOOH/CH3COCOO-) = 2,5.
Calculez le pH de la solution γ résultant du mélange des solutions α et β.
Correction :
Solution α :
HCOOH a un pKa compris entre 0 et 14 exclus et est l'acide du couple HCOOH/HCOO- étant donné que ça en est le premier terme, c'est donc un acide faible. Nous allons commencer par calculer la concentration de l'espèce considérée dans la solution. La quantité de HCOOH présente a été donnée en moles, donc pour trouver la concentration on procède comme suit, en pensant bien à prendre le volume en litres :
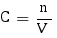


Ainsi avec C = 3,95×10-1 mol.L-1 nous pouvons calculer le pH de la solution. Étant donné qu'elle contient un acide faible le pH se calcule comme suit :
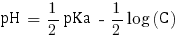


pHα = 2.1
Solution β :
CH3COCOO- a un pKa compris entre 0 et 14 exclus et est capable de capter un proton grâce à une charge négative, c'est donc une base faible. Nous allons commencer par calculer la concentration de l'espèce considérée dans la solution. La quantité de CH3COCOO- présente a été donnée en moles, donc pour trouver la concentration on procède comme suit, en pensant bien à prendre le volume en litres :
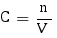


Ainsi avec C = 9,20×10-2 mol.L-1 nous pouvons calculer le pH de la solution. Étant donné qu'elle contient une base faible le pH se calcule comme suit :
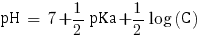


pHβ = 7.7
Solution γ :
Nous avons ici le mélange d'un acide faible et d'une base faible, ce qui veut dire qu'aucune réaction ne se produit. L'acide est trop faible pour céder un proton et la base est trop faible pour forcer l'acide à le faire, donc les deux espèces restent en tête à tête sans rien faire et la réaction n'avance pas.
Nous allons tout d'abord calculer les nouvelles concentrations des espèces dans le mélange :
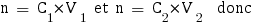
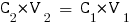



Avec ces valeurs nous pouvons enfin calculer le pH de la solution, qu'on trouve avec la formule utilisée pour les sels d'acide faible et de base faible ou les acides aminés :