Acides-bases
Calculez le pH d'une solution α de 45 mL dans laquelle on dissout 1,27×10-1 grammes de CN-.
Données : pKa (HCN/CN-) = 9,4, et MCN- = 27 g.mol-1.
Calculez le pH d'une solution β de 40 mL dans laquelle on dissout 3,70×10-1 grammes de HCN.
Données : pKa (HCN/CN-) = 9,4, et MHCN = 27 g.mol-1.
Calculez le pH de la solution γ résultant du mélange des solutions α et β.
Correction :
Solution α :
CN- a un pKa compris entre 0 et 14 exclus et est la base du couple HCN/CN- étant donné que ça en est le deuxième terme, c'est donc une base faible. Nous allons commencer par calculer la concentration de l'espèce considérée dans la solution. La quantité de CN- présente a été donnée en grammes, donc pour trouver la concentration on procède comme suit, en pensant bien à prendre le volume en litres :
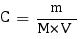


Ainsi avec C = 1,04×10-1 mol.L-1 nous pouvons calculer le pH de la solution. Étant donné qu'elle contient une base faible le pH se calcule comme suit :
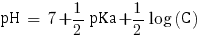


pHα = 11.2
Solution β :
HCN a un pKa compris entre 0 et 14 exclus et est capable de céder un proton, c'est donc un acide faible. Nous allons commencer par calculer la concentration de l'espèce considérée dans la solution. La quantité de HCN présente a été donnée en grammes, donc pour trouver la concentration on procède comme suit, en pensant bien à prendre le volume en litres :
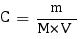


Ainsi avec C = 3,43×10-1 mol.L-1 nous pouvons calculer le pH de la solution. Étant donné qu'elle contient un acide faible le pH se calcule comme suit :
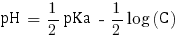

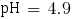
pHβ = 4.9
Solution γ :
Nous avons ici le mélange d'un acide faible et de sa base faible conjuguée, ce qui veut dire que nous sommes face à une solution tampon.
Nous allons tout d'abord calculer les nouvelles concentrations des espèces dans le mélange :
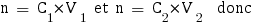
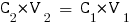



Avec ces valeurs nous pouvons enfin calculer le pH de la solution, qu'on trouve avec la formule utilisée pour les solutions tampon :


