Acides-bases
Calculez le pH d'une solution α de 60 mL dans laquelle on dissout 7,82×10-2 grammes de NH3OH+.
Données : pKa (NH3OH+/NH2OH) = 5,95, et MNH3OH+ = 34 g.mol-1.
Calculez le pH d'une solution β de 20 mL dans laquelle on dissout 1,94×10-1 grammes de NH2OH.
Données : pKa (NH3OH+/NH2OH) = 5,95, et MNH2OH = 34 g.mol-1.
Calculez le pH de la solution γ résultant du mélange des solutions α et β.
Correction :
Solution α :
NH3OH+ a un pKa compris entre 0 et 14 exclus et est capable de céder un proton, c'est donc un acide faible. Nous allons commencer par calculer la concentration de l'espèce considérée dans la solution. La quantité de NH3OH+ présente a été donnée en grammes, donc pour trouver la concentration on procède comme suit, en pensant bien à prendre le volume en litres :
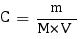


Ainsi avec C = 3,83×10-2 mol.L-1 nous pouvons calculer le pH de la solution. Étant donné qu'elle contient un acide faible le pH se calcule comme suit :
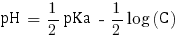


pHα = 3.7
Solution β :
NH2OH a un pKa compris entre 0 et 14 exclus et est capable de capter un proton grâce à un doublet non liant sur l'azote, c'est donc une base faible. Nous allons commencer par calculer la concentration de l'espèce considérée dans la solution. La quantité de NH2OH présente a été donnée en grammes, donc pour trouver la concentration on procède comme suit, en pensant bien à prendre le volume en litres :
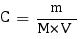


Ainsi avec C = 2,85×10-1 mol.L-1 nous pouvons calculer le pH de la solution. Étant donné qu'elle contient une base faible le pH se calcule comme suit :
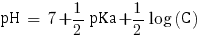


pHβ = 9.7
Solution γ :
Nous avons ici le mélange d'un acide faible et de sa base faible conjuguée, ce qui veut dire que nous sommes face à une solution tampon.
Nous allons tout d'abord calculer les nouvelles concentrations des espèces dans le mélange :
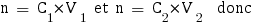
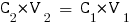



Avec ces valeurs nous pouvons enfin calculer le pH de la solution, qu'on trouve avec la formule utilisée pour les solutions tampon :


